NAR | 谢安勇课题组发现BRCA1肿瘤基因组“疤痕”形成新机制
研究背景
基于BRCA1在DNA双链断裂(double strand break,DSB)修复和基因组稳定性维持中的关键作用,BRCA1缺陷肿瘤基因组记录了肿瘤形成过程中细胞遭遇的DNA损伤事件和BRCA1缺陷引起的异常修复,呈现了特征性的突变模式(Mutational signatures)的富集。这些突变模式包括成簇点突变、短片段碱基增删(InDel)、易位和微同源序列(Microhomology,MH)介导的11 Kb的串联倍增(Tandem duplication,TD)1。这些特征性的突变模式可以用于预测同源重组缺陷、指导癌症药物PARP抑制剂临床用药。然而,BRCA1缺陷导致基因组中这些突变模式累积的机制并不十分清楚2。先前,利用复制偶联DSB的定点诱导系统及DSB修复分析方法,我们发现,BRCA1缺陷肿瘤突变模式的一个主要诱因是源于DNA单链断裂(Single strand break,SSB)的复制偶联单末端DSB的产生及修复异常,而不是传统认为的独立于DNA复制的双末端DSB3。但是,解析特征性的MH介导的TD形成机制受限于所用系统中邻近DNA重复序列的干扰,难以真正捕捉在没有邻近重复序列的基因组区域中的TD形成机制,而这种区域超过50%的全基因组。因此,BRCA1缺陷肿瘤中复制偶联DSB修复异常如何产生特征性TD依旧未知。
论文概要

2025年7月30日,浙江大学医学院附属邵逸夫医院、浙江大学转化医学研究院谢安勇课题组在Nucleic Acids Research杂志在线发表了题为“Late steps of allelic break-induced replication suppress tandem duplication associated with BRCA1 deficiency”的研究论文。研究团队创新性地创建了无重复序列的TD报告系统以及内源性位点特异性TD定点诱导和检测方法,发现BRCA1缺陷导致修复复制偶联DSB的最常用、最精准的HR亚途径“等位断裂诱导复制途径(Allelic break-induced replication, aBIR)”失灵,从而诱导特征性MH介导的TD的富集。具体地,在复制偶联DSB的aBIR修复过程中,由于BRCA1缺陷,复制偶联DSB末端在第一轮等位链入侵后过早终止DNA合成,解离的新生链更多利用MH进行非等位的第二轮链入侵,启动MH介导的BIR(MH-mediated BIR,MMBIR),从而提高MH介导TD的形成。这条途径因此称之为aBIR-MMBIR,是首次揭示的TD形成新途径。
结果分析与阐述
为了能在无重复序列基因组区域定点分析TD的产生频率和机制,研究团队在小鼠胚胎干细胞中建立了一个TD报告系统,在这个报告系统上,利用Cas9缺刻酶(如Cas9D,代表Cas9 D10A;Cas9H,代表Cas9 H840A)定点诱导复制偶联DSB。这种DSB可能利用如下两种机制形成MH介导的TD产物,产生RFP+细胞:MMBIR和aBIR-MMBIR(图1)。同时也在内源位点建立了不依赖于报告系统的TD定点产生和分析方法,并连同TD报告系统,进行了测试和验证。通过比较BRCA1正常细胞和缺陷细胞的复制偶联DSB诱导的TD形成,研究团队发现,BRCA1缺陷显著提升TD发生频率(图1),该现象与经典型非同源末端连接(c-NHEJ)无关。而且,TD产物结构的分析显示,MMBIR和aBIR-MMBIR的确是复制偶联DSB诱导产生TD的两个主要机制。
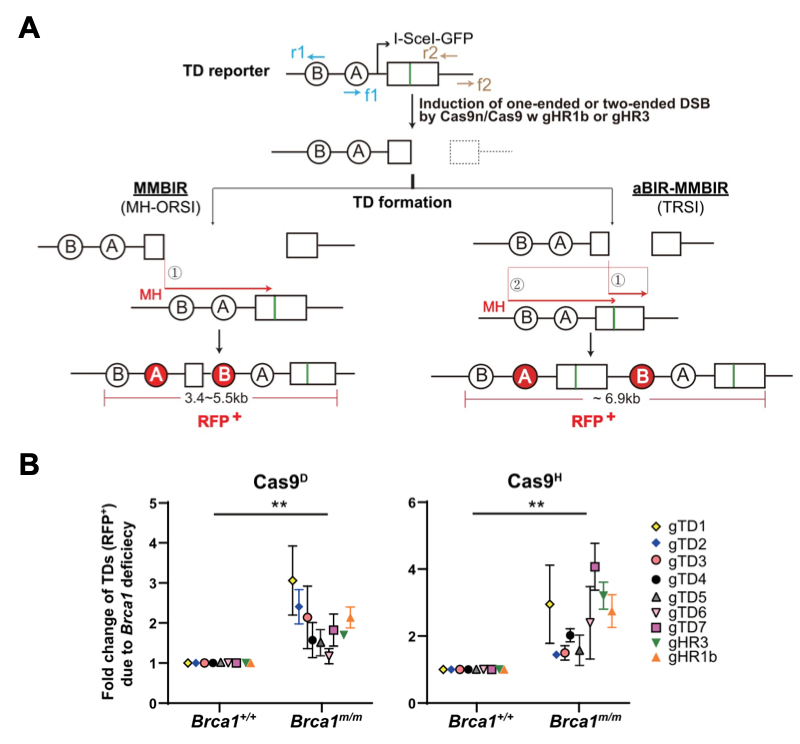
图1.BRCA1缺陷提升复制偶联DSB诱导的TD发生频率。A:复制偶联DSB诱导的TD形成的两种可能机制; B:在BRCA1正常和缺陷细胞中复制偶联DSB诱导的TD形成频率。
但是,BRCA1的RAD51加载功能缺失并不导致TD产物提升。无论是RAD51或BRCA2敲减,还是用于加载RAD51的BRCA1 coiled-coil结构域的缺失,都没有提升TD形成,反而降低。另一方面,在BRCA1的C-端结构区域缺失时,BRCA1功能受损,TD富集,但RAD51的敲减不改变这种BRCA1缺陷细胞的TD提升水平(图2)。这表明,BRCA1缺陷相关的TD形成机制部分依赖于RAD51,部分不依赖。
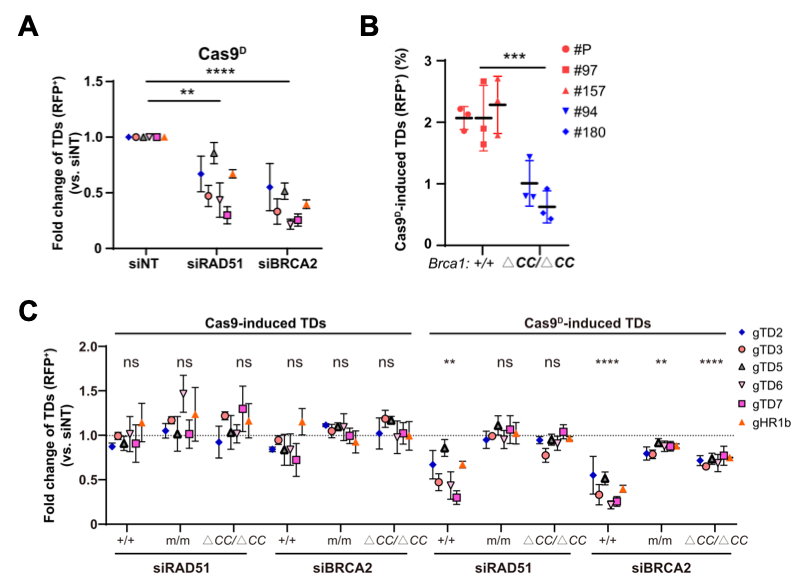
图2.复制偶联DSB诱导的TD形成需要BRCA1的RAD51加载功能。A:RAD51和BRCA2敲减降低复制偶联DSB诱导的TD形成;B: BRCA1的CC结构域缺失降低复制偶联DSB诱导的TD形成;C:BRCA1缺陷细胞中复制偶联DSB诱导的TD形成不受RAD51敲减的影响。
考虑到RAD51加载对同源序列搜寻和链侵入至关重要,RAD51依赖性提示,BRCA1的TD抑制机制也可能发生在链侵入之后。进一步的研究发现,RAD54缺失提高BRCA1缺陷相关的TD形成。因为RAD54促进同源序列搜寻和链侵入,这提示,RAD54抑制RAD51依赖的TD形成。此外,BARD1缺失也提高TD水平,而且是通过影响RAD51结合,因此,我们推测,BRCA1-BARD1复合体是通过结合RAD51稳定D-loop延伸,防止新生链提前脱离,进而抑制TD形成(图3)。这些结果均表明BRCA1可以通过调控aBIR后期步骤抑制TD形成。
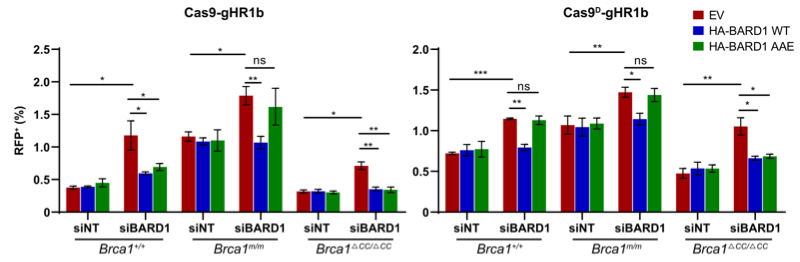
图3.BRA1抑制复制偶联DSB诱导的TD形成部分通过BARD1-RAD51互作实现。
值得一提的是,在aBIR-MMBIR途径中,aBIR阶段的DNA合成可利用等位基因序列完美修复原始断裂点,使TD产物中DNA原始断裂点呈现"无疤痕"特征。而传统的全基因组分析通常不能识别这种隐藏的“无疤痕”断裂点4,可能误将微同源序列接口判为断裂点,据此推导出错误的机制来解释TD的形成,比如误认为是单纯的MMBIR机制,从而掩盖了本研究发现的真实的aBIR-MMBIR机制。
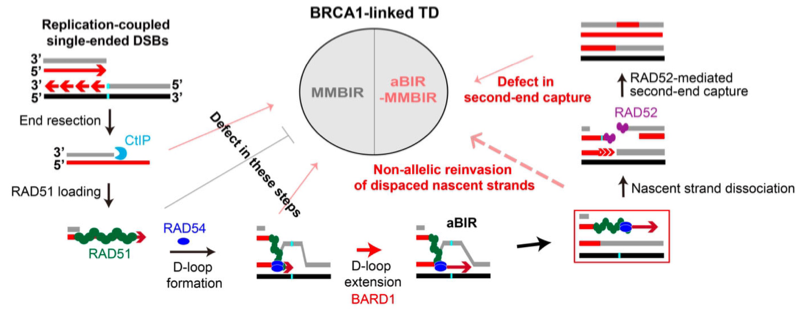
图4.BRCA1抑制复制偶联DSB诱导的TD形成的机制示意图。
研究总结
本研究通过建立无重复序列干扰的TD定点诱导和分析研究工具,真实模拟无临近重复序列基因组TD形成环境。在此基础上开展的研究不仅表明复制偶联DSB是诱导BRCA1缺陷相关TD形成的主要DNA损伤来源之一,而且首次揭示BRCA1通过调控复制偶联DSB修复的aBIR途径晚期步骤抑制TD形成以及RAD51在其中扮演的双面角色(图4)。这些研究发现不仅为理解BRCA1缺陷相关特征性TD的形成机制提供了新视角,提升领域内对BRCA1缺陷肿瘤基因组不稳定性的认识,也为新诊疗策略的开发提供了重要的理论基础。此外,Cas9缺刻酶Cas9D和Cas9H在BRCA1正常细胞中也诱导TD的高频产生,警示在基于Cas9缺刻酶的基因组编辑应用(比如碱基编辑和引导编辑)中产生异常染色体重排的潜在风险5。
原文链接DOI:https://doi.org/10.1093/nar/gkaf729。
作者简介
浙江大学医学院附属邵逸夫医院/浙江大学转化医学研究院谢安勇为本文的通讯作者。黄志成博士为本文的第一作者。本研究受到科技部重大项目、国家自然科学基金和杭州市科技局项目经费支持。
参考文献:
[1] Menghi F, Barthel FP, Yadav V et al. The tandem duplicator phenotype is a prevalent genome-wide cancer configuration driven by distinct gene mutations. Cancer Cell 2018; 34:197–210.
[2] Davies H, Glodzik D, Morganella S et al. HRDetect is a predictor of BRCA1 and BRCA2 deficiency based on mutational signatures. Nat Med 2017; 23:517–25.
[3] Feng Y-L, Liu Q, Chen R-D et al. DNA nicks induce mutational signatures associated with BRCA1 deficiency. Nat Commun 2022; 13:4285
[4] Lam HYK, Mu XJ, Stütz AM et al. Nucleotide-resolution analysis of structural variants using BreakSeq and a breakpoint library. Nat Biotechnol 2010; 28:47–55
[5] Tao J, Bauer DE, Chiarle R.Assessing and advancing the safety of CRISPR–Cas tools: from DNA to RNA editing. Nat Commun 2023; 14:212


