Autophagy|梁平教授团队揭示过度自噬介导的MYLK3降解导致舒尼替尼引起的心脏毒性
舒尼替尼是一种选择性靶向多种受体的酪氨酸激酶抑制剂,已被批准用于多种癌症的一线治疗。然而,临床数据显示,接受该药物治疗的患者可能出现左心室射血分数降低、心律失常和心力衰竭等心脏不良反应,这些毒性作用在一定程度上限制了其临床应用。研究表明,舒尼替尼可导致心脏电生理改变,但其诱发心律失常的具体分子机制尚不清楚。
2025年6月26日,宁波大学附属第一医院省重点实验室团队与浙江大学转化医学研究院梁平教授团队合作,在Autophagy杂志在线发表了题为“Excessive autophagic degradation of MYLK3 causes sunitinib-induced cardiotoxicity”(肌球蛋白轻链激酶3(MYLK3)的过度自噬降解导致舒尼替尼引起的心脏毒性)的研究论文。该研究利用人类诱导多能干细胞分化的心肌细胞(iPSC-CMs)和C57BL/6小鼠模型,揭示了舒尼替尼引起的过度自噬会导致肌球蛋白轻链激酶3 (MYLK3) 降解,进而抑制CAMK2-PLN-ATP2A2a信号通路,最终破坏Ca²⁺稳态并诱发心律失常。

研究发现,与未处理的对照组相比,经舒尼替尼处理的iPSC-CMs重现了临床药物毒性表型,包括细胞活力降低、细胞凋亡增加、肌节结构紊乱、心律失常、钙离子(Ca²⁺)稳态异常以及过度自噬。蛋白质质谱测序和免疫共沉淀分析表明,在舒尼替尼诱导的过度自噬过程中,MYLK3与SQSTM1结合并通过自噬途径降解,导致细胞内MYLK3蛋白水平显著下调。
此外,在舒尼替尼处理的iPSC-CMs中,MYLK3的下调伴随着CAMK2和PLN磷酸化水平的降低;而恢复MYLK3活性则可显著提升CAMK2和PLN的磷酸化。在正常心肌细胞中,MYLK3与Ca²⁺-CALM形成复合物共同调节下游信号通路;当其与Ca²⁺-CALM分离时,MYLK3则失去活性。因此,这些结果提示,在正常状态下,MYLK3可能通过与Ca²⁺-CALM结合促进CAMK2和PLN的磷酸化。然而,在舒尼替尼作用下,MYLK3的过度降解导致其活性丧失,从而抑制了CAMK2-PLN-ATP2A2a信号通路,最终破坏Ca²⁺稳态并诱发心律失常。上述蛋白共同构成了一个精细调控心肌细胞功能的网络。值得注意的是,这些表型在MYLK3基因敲除(KO)的iPSC-CMs中也得到了重现。
应用自噬抑制剂(ULK1抑制剂MRT68921)、心肌肌球蛋白激活剂omecamtiv mecarbil (OM) 或过表达MYLK3,均能显著恢复舒尼替尼处理的iPSC-CMs中MYLK3的表达水平,并逆转其致病表型。更重要的是,通过PCM-PEG2000-DSPE纳米颗粒递送OM,有效预防了舒尼替尼给药小鼠出现的心脏功能受损、心律失常、心脏重量/体重比降低、心肌损伤、Ca²⁺稳态异常以及心肌细胞收缩功能障碍等表型。
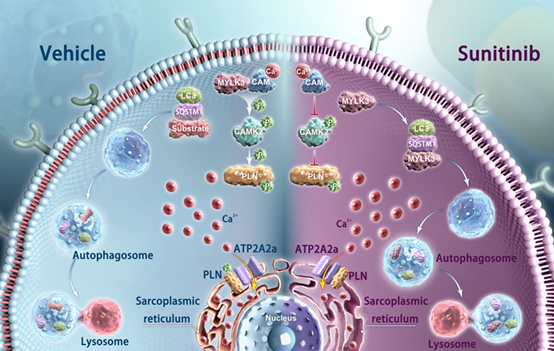
综上所述,本研究揭示舒尼替尼通过介导MYLK3的过度降解,抑制了CAMK2-PLN-ATP2A2a信号通路,进而破坏Ca²⁺稳态并诱发心律失常。因此,MYLK3 是治疗舒尼替尼诱导心脏毒性的一个潜在心脏保护靶点。
本文的共同第一作者为宁波大学附属第一医院心脏中心与浙江大学梁平教授团队联合培养博士后潘紫薇、宁波大学附属第一医院省重点实验室科研助理竺璐捷,以及浙江大学梁平教授团队科研助理王晓晨。共同通讯作者为宁波大学附属第一医院省重点实验室助理研究员沈嘉希与浙江大学梁平教授。此外,崔翰斌主任团队、陈静海教授团队及傅秋黎教授团队亦对本文提供了指导。


